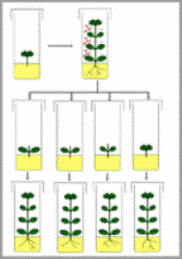
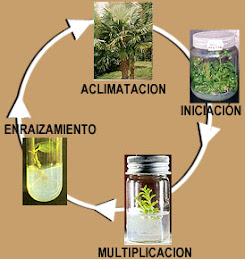
El uso de biotecnologías como la micropropagación resultan útiles para preservar o perpetuar la genética de algún fitomaterial de interés, rescatar y producir a gran escala el material vegetal, esto resulta muy beneficioso ya que permite obtener plántulas de mejor estirpe y mejoradas para una mayor producción. El desarrollo de esta técnica reúne protocolos como: 1) Desinfestación de las yemas de la planta y/o de semillas, 2) Introducción del material seleccionado in vitro, 3) Multiplicación de brotes, 4) Enraizamiento 5) Aclimatación; el procedimiento consiste en la incubación, en condiciones controladas y asépticas, de una célula o parte de un tejido vegetal (hoja, tallo, raíz, embrión, semilla, meristema, polen, etc.) en un medio que contiene elementos nutritivos, como sacarosa, vitaminas, fitohormonas, humedad entre otros . La micropropagación puede ser aplicada en diferentes especies vegetales, cada proceso requiere un estricto control, observación adecuada manipulación para obtener los resultados deseados.
The use of biotechnologies like as micropropagation are useful to preserve or perpetuate the genetics of interest biomaterial, save and produce to large scale vegetable material, this is very beneficial as it allows better category seedlings and improved for greater production. The process of this technique meets protocols such as 1) Disinfection of the buds of the plant and / or seeds 2) Introduction of selected material in vitro, 3) Multiplication of outbreaks 4) Rooting 5) Acclimatization, the procedure involves the incubation in conditions controlled and aseptic, from cell or plant tissue (leaf, stem, root, embryo, seed, meristem, pollen, etc...) on a medium containing nutrients such as sucrose , vitamins, plant-hormones, humidity and others. , Micropropagation can be applied in different vegetables species. Each process requires control, proper handling observation to obtain the desired results.
INTRODUCCIÓN
La micropropagación persigue objetivos de interés productivo y de preservación de especies nativas.
En la parte productiva se puede destacar la obtención de cultivos sanos y seleccionados para potencializar su desempeño a gran escala entre los cuales han tenido éxito y han se incorporado el cultivo de yuca, palma de aceite, plantas ornamentales, patata, tomate, etc.… esto quiere decir que su aplicabilidad es extensa.
La necesidad de generar biocombustibles también implica en gran medida el uso de la micropropagación en materiales vegetales como la caña de azúcar y el maíz para generar etanol (alcohol) como sustituto del petróleo
También tiene la gran ventaja de producir metabolitos secundarios como aceites esenciales, saponinas, alcaloides para uso medicinal y enzimas
En la parte de preservación se han y se siguen creando bancos de germoplasma de especies convenientemente selectas por posibles extinciones (causadas por contaminación) o para intercambios internacionales.
- Selección del inóculo apropiado
- Desinfestación ( eliminación de los microorganismos que se encuentran en la superficie de los inóculos)
- Elección del medio de cultivo
- Condiciones apropiadas de incubación para el óptimo desarrollo y crecimiento.
SELECCIÓN DEL INÓCULO:
Dependerá de la especie que se va a propagar y de los objetivos que se pretenden. Se recomienda en caso de desconocimiento de la especie intentar con diferentes partes de la planta madre donante como: meristemos, tallos, semillas, flores, hojas y observar con cual inóculo se obtienen mejores resultados.
Para la selección del inóculo se debe tener presente la calidad de la planta madre, la edad fisiológica de la planta madre y del inóculo, época del año, tipo y tamaño del inóculo.
Las condiciones fitosanitarias y fisiológicas de la planta madre donante deben encontrarse satisfactorias de ello dependerá el éxito de la micropropagación. Las plantas enfermas o débiles no califican para este procedimiento.
La obtención de inóculos a partir de plantas jóvenes sostiene mejores respuestas ya que el desarrollo de la morfogénesis es más veloz.
Es incidente la época del año en que adquieren los inóculos, la planta madre puede encontrarse más vigorosa en ciertas épocas del año.
Es decisivo el tipo de inóculo a utilizar (brotes, tallos, hojas, meristemos o semillas) de ello depende la capacidad morfogénica, esto asociado al tamaño ya que si el inóculo es muy pequeño tiene la ventaja de contaminarse en menor proporción pero tiene el inconveniente de reducir las posibilidades de una respuesta positiva. ( Álvarez et al)
DESINFESTACIÓN DE LOS INÓCULOS
Es eliminación de los microorganismos (bacterias hogos y levaduras) que se encuentran en la superficie de los inóculos y que en el momento de la siembra y desarrollo establecen competencia con el inóculo disminuyendo los nutrientes que este requiere para su desarrollo al igual que la producción de metabolitos tóxicos que afectan crecimiento y enraizamiento del inóculo.
Este procedimiento puede realizarse con desinfectantes como hipoclorito de calcio, hipoclorito de sodio, peróxido de hidrogeno, nitrato de plata o cloro comercial estos agentes desinfectantes pueden actuar como bactericidas y/ o bacteriostáticos.
Método de desinfestación:
- Lavar el material biológico con detergente y enjuagar para eliminar polvo, insectos etc.…
- Mantener el material en un ambiente aséptico, donde se sumerge por unos minutos en etanol al 70%.
- Sumergir el material biológico en el agente desinfectante para eliminar los microorganismos. El tiempo de desinfestación es importante ya que si es prolongado puede dañar el tejido del inóculo y si es corta los microorganismos no serán removidos.
- Lavar el material biológico con agua destilada estéril para eliminar el agente desinfectante, el inóculo debe mantenerse en agua destilada hasta el momento de la siembra.( Rosales y Arredondo)
INTRODUCCIÓN DEL MATERIAL IN VITRO
Luego de la desinfección superficial, las semillas o las yemas dependiendo del material seleccionado, se ponen en medio de cultivo estéril. En un período de una semana o quince días, comienza el proceso de germinación o regeneración de nuevos tejidos vegetales, iniciando el ciclo de cultivo in vitro. Micropropagation - Definitions from Dictionary.com». dictionary.reference.com. Consultado el 17-03-2008.
SELECCIÓN DEL MEDIO DE CULTIVO
Cada planta requiere de nutrientes específicos, es por esta razón no hay un estándar en el medio de cultivo, a cambio de esta situación, se han desarrollado diferentes fórmulas en la constitución del medio, pero como base de todos los medios de cultivos estos deben contener:
- Sales inorgánicas:
Macronutrientes: Nitrógeno, Fósforo, Calcio, Magnesio y Azufre.
Micronutrientes: Cobre, Zinc, Manganeso, Hierro, Cloro, Molibdeno y Boro
- Sustancias inorgánicas:
Aminoácidos, carbohidratos, fitohormonas y vitaminas. - Compuestos naturales de origen animal o vegetal:
Caseína hidrolizada
Jugo de tomate, agua de coco, pulpa de plátano - Agua destilada:
Donde se incorporan y disuelven todos los elementos.
La consistencia del medio puede ser líquida y se usan filtros de fibra de vidrio, papel o borra de poliéster etc.… que sirven como soporte o consistencia semisólida donde el agar es el medio de soporte, eso dependerá del inoculo. (Álvarez et al)
Preparación del medio de cultivo:
Preparar soluciones concentradas de macronutrientes, micronutrientes, vitaminas y hormonas vegetales.
- Tomar las cantidades necesarias.
- Llevar a un recipiente con agua destilada e integrar.
- Incorporar un carbohidrato.
- Adecuar pH.
- Calentar y agregar agar al medio de cultivo en caso de que se requiera el medio semisólido.
- Esterilizar en autoclave en recipientes convenientes para este procedimiento.
- Dejar enfriar. ( Rosales et al)
MULTIPLICACIÓN DE LOS BROTES
Para enraizar los explantos se utilizan principalmente plantines individuales de un tamaño aproximado de 2 cm. Los brotes obtenidos durante la fase de multiplicación se transfieren a un medio libre de reguladores de crecimiento o que solo contenga hormonas del tipo de las auxinas. Algunas especies de plantas no necesitan pasar por esta etapa y emiten sus raíces en el mismo medio de cultivo donde desarrollan yemas nuevas, por lo tanto el proceso de multiplicación y enraizamiento transcurren en forma simultánea. (Castillo, A. 2004. Propagación de plantas por cultivo in vitro: una biotecnología que nos acompaña hace mucho tiempo).
CONDICIONES DE INCUBACIÓN
- Temperatura:
Habitualmente, los cultivos se conservan a una temperatura constante de 20°C a 30°C, existen algunas excepciones de especies que requieren frío para su desarrollo. - Luz:
Fotoperiodo, duración diurna de la luz
Longitud de onda e intensidad
Intervienen en la síntesis de sustancias como hormonas endógenas, acumulación de almidón y desarrollo del inóculo. (Rosales et al)
ADAPTACIÓN A CONDICIONES AMBIENTALES
Es la etapa en la cual las plántulas obtenidas in vitro son transferidas cuidadosamente a condiciones ambientales normales.
En este proceso ocurre la mayor tasa de muerte por deshidratación debido a la carencia de cera epicuticular o ineficiente función estómática.
El cambio drástico del medio de cultivo al suelo también genera dificultades en la adaptación de las plántulas, en el medio ellas encuentran la sacarosa necesaria para su desarrollo y no realizan el proceso de fotosíntesis mientras que en el suelo no encuentran este compuesto disponible, por lo cual las plántulas deben comenzar un acoplamiento para elaborar azúcares por medio del proceso fotosintético y obtener su propio alimento. (Arredondo)
ENRAIZAMIENTO
Estos plantines se plantarán en contenedores (almacigueras) cubiertos por un plástico, para mantener la humedad relativa elevada. La elección de un sustrato con buenas características físicas, es clave para el éxito de esta etapa. Para el trasplante, elegimos un sustrato suelto, poroso, con mezcla de arena turba, cáscara de arroz quemado, para permitir un desarrollo y crecimiento de raíces muy rápido. Las mezclas son diferentes y muy variadas de acuerdo a la especie con la que estamos trabajando. Luego de retirar cuidadosamente el agar de las raíces para evitar dañarlas, los plantines se enjuagan y se colocan en almacigueras con la mezcla de sustratos seleccionada y cubiertos con nylon. Todos los días se debe controlar el nivel de humedad en las almacigueras. Si es necesario, se aplica un riego con una pulverizadora manual, para mantener un ambiente húmedo a nivel del sustrato. A los 15 días del trasplante, se puede comenzar a levantar la cobertura de nylon en las horas de menor calor ( temprano en la mañana o en la última hora de la tarde). Al comienzo las plantas se dejan media hora por día destapadas. A la semana siguiente se dejan destapadas durante una hora. Al mes del trasplante, se dejan tapadas durante la noche y si hay crecimiento de nuevas hojas, las plantas pueden permanecer destapadas. Las condiciones del cultivo in vitro, generan cambios en algunos aspectos anatómicos y fisiológicos de las plantas, por esta causa, durante la aclimatación, los cambios deben ser muy graduales, para minimizar el estrés y tener mayor tasa de sobrevivencia. INIA, Uruguay. Beltrán, J. y I. Barrios. 2004. Micropropagación in vitro de la caña flecha (Gynerium sagittatum) (Aubl)
(Welander, Physiol. Plant. 58:231, (1983); Zimmerman y Fordham, J. Amer. Soc. Hort. Sci. 110: 34 (1985) han propuesto una técnica híbrida, que combina las ventajas del enraizamiento in vitro y ex vitro. Para ello las microestaquillas son incubadas inicialmente en un medio estéril que incluye hormonas para la inducción de raíces y azúcares, durante un periodo de 3 a 7 días, para la inducción-inicio de las raíces. Esto se puede hacer en un medio sólido o líquido normalmente en oscuridad. Luego el material es repicado en un medio no estéril, o incluso transplantado a tierra, para la fase de elongación y desarrollo de las raíces, mejorándose de esta forma en muchos casos el resultado final de aclimatación y supervivencia.
Otros autores (Driver y Shutle, Eds., Cell and Tissue Culture in Forestry Vol. II (1987) proponen realizar el enraizamiento y la aclimatación simultáneamente, transplantando las microestaquillas directamente en el campo, después de una etapa previa de endurecimiento in vitro: tras la inducción del enraizamiento, las plantas aún en condiciones in vitro eran sometidas a una elevada intensidad luminosa, un fotoperiodo más corto y una temperatura inferior a la normal, durante un par de semanas. Esto favorecía la lignificación y el desarrollo cuticular y estomático del material y permitía su transplante directo al campo en condiciones controladas de humedad, luz y nutrientes.
ENRAIZADOR
La aplicación de hormonas enraizadoras tipo auxina regulan el crecimiento de la microestaca, este es agregada en la base de la misma. Para prevenir la contaminación con hongos se utilizan enraizadores mezclados con fungicidas.
EMBRIOGÉNESIS SOMÁTICA
La embriogénesis es el desarrollo de formación del embrión. Dependiendo del origen de la célula de la cual procede este proceso y de las condiciones en las que ocurre, se puede hablar de embriogénesis zigótica, gamética y somática. Esta última es el proceso en el cual las células somáticas de un tejido cultivado en ciertas condiciones, semejantes a aquellas en las que se desarrolla la embriogénesis zigótica, son capaces de formar un embrión (Ostrolucka, 1995).
Los embriones somáticos son estructuras bipolares con un eje radical apical y no poseen conexión vascular con el tejido materno; estas estructuras son capaces de crecer y formar plantas normales (Sannnasgala, 1989; Scalat y Teissont, 1989,, citado por Gómez, 1998)
Al contrario de los embriones Zigóticos, los embriones somáticos no contienen un nuevo grupo de genes, poseen la misma combinación genética de la planta madre.
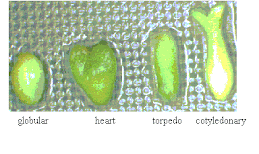
Morfológicamente, un embrión somático es muy similar a uno zigótico, sobre todo en su desarrollo evolutivo, desde proembrión, estado globular, corazón y torpedo hasta estado cotiledonar o embrión maduro. (Gómez, 1998)
Durante el estado globular del desarrollo, de la división celular producida genera un embrión pequeño. En seguida, el desarrollo al estado de corazón implica el establecimiento de una simetría bilateral para producir lóbulos distales, que constituyen los precursores de los cotiledones y el establecimiento de los tejidos fundamentales de la plántula: La epidermis, tejido fundamental y tejido vascular (Mayer et el, 10991, citado por Lindsey y Topping, 1993)
Los embriones en estado de corazón pueden comenzar a acumular clorofila y continuar la elongación axial al estado de torpedo, para generar un hipocótilo mas definido y eventualmente, los cotiledones. El embrión maduro está conformado por un brote apical que aún no se encuentra desarrollado, mientras que los primordios foliares estén ausentes ( Lindsey y Topping, 1993)
Potencialmente, todas las células somáticas de una planta contienen la información genética necesaria para crear una nueva planta completa y funcional. La inducción de la embriogénesis somática consiste en el bloqueo del patrón de expresión de los genes presentes en el tejido del explante, siendo reemplazado con otro programa de expresión de genes, o gen, de la embriogénesis en aquellas células del tejido del explante, las cuales podrían dar lugar a embriones somáticos. (Evans et al 1981. Posteriormente Sharp et al 1984)
CULTIVO DE EMBRIONES
Es una técnica de cultivo de tejidos en la cual los embriones zigóticos se separan de los tejidos maternos y de reserva y se cultivan asépticamente en un medio artificial, con el fin de obtener plántulas viables (Pierk, 1990; Montoya, 1994). La posibilidad de romper la dormancia de embriones a través de su cultivo in vitro permite, también, hacer uso de esta técnica para pruebas rápidas de viabilidad. La germinación de embriones separados ha sido reconocida como una prueba más segura y confiable que los métodos de tinción, rutinariamente usados para análisis de viabilidad de semillas (Montoya, 1991)
El cultivo de embriones es usado con diferentes propósitos: estudiar los requerimientos nutricionales de embriones en desarrollo, romper los periodos de dormancia de semillas, rescatar embriones híbridos originados en cruzamientos interespecíficos e intergenéricos que, frecuentemente, producen semillas no viables por incompatibilidad, aborto embrionario, anomalías en el desarrollo del embrión y mutaciones ( Litz, 1991) También su uso se aplica para el rescate de embriones, para transferencia de resistencia a enfermedades producidas por hongos, virus o nematodos y a baja temperaturas y para rescate de materiales frutales deciduos, cuyas semillas son generalmente de baja viabilidad ( Tuckey, 1935. Blake, 1993. Danielsson, 1950. Citado por Roca y Mroginski, 1991)
Dos aspectos importantes en el cultivo de embriones son la composición del medio y la escisión del embrión. La composición del medio y la preparación del explate para el cultivo aséptico puede variar según la madre la edad del embrión por cultivar (Montoya, 1991)
En los medios se requiere una fuente de energía disponible para el cultivo de embriones maduros e inmaduros; la sacarosa es la más utilizada. Esta se adiciona al medio no sólo como fuente d energía, sino para mantener una osmolaridad adecuada, factor extremadamente importante durante el cultivo de embriones inmaduros (Montoya, 1991)
La adición de agentes antioxidantes, como el ácido ascórbico, puede prevenir la oxidación de tejidos causada por la liberación de compuestos fenólicos (Roca y Mroginski, 1991; George, 1996)
La adición de auxinas al medio acelera la inducción y producción de brotes cuando se logra una relación óptima de auxina-citoquinina; además, permite la germinación y maduración de los embriones (Litz, 1991). La presencia de citoquininas es de gran importancia para activar la yema apical y promover el desarrollo de yemas axilares ( Vieitez et al, 1985)
Durante el desarrollo de embriones se han distinguido dos fases con respecto a la nutrición:
- Fase heterotrófica: en la cual el embrión es dependiente del endospermo y de los tejidos maternos.
- Fase autótrofa: durante la cual el embrión adquiere la capacidad metabólica para sintetizar las sustancias requeridas para su crecimiento y desarrollo ( Litz, 1991)
CONCLUSIONES
- Se puede obtener un gran número de plantas a partir de un solo tejido de la planta donadora.
- El tiempo requerido para lograr un número considerado de plantas es corto comparado con el cultivo convencional.
- Las condiciones controladas para cultivar plantines confiere la oportunidad de aplicar la biotecnología de la micropropagación en cualquier época del año.
- Se aprovecha el área de siembra ya que ocupan poco espacio originando amplitud para más plántulas.
- Se pueden adquirir plantas exentas de agentes patógenos haciendo promisorio su futuro productivo.
- Un tratamiento de desinfección adecuado permite obtener niveles altos de asepsia y de sobrevivencia de los explantes que se tomen en cualquier estudio.
- Tener embriones somáticos disponibles permite destinarlos a programas de mejoramiento o a la propagación a gran escala de genotipos superiores, especialmente en cultivos perennes de alto valor.
- Los materiales y aparatos especializados para disponer de la micropropagación ocasionan costos lo cual hace que sea usada parcialmente.
REFERENCIAS
-ACOSTA, F. GUSTAVO. Contenido didáctico del curso Biotecnología l. Bogotá. Sep 2009.
-ALVAREZ. B. AMADEO, ROSALES. L. BARBARA. Susana, ARREDONDO. R. JUAN. Micropropagación de plantas. Ed. trillas.
- Castillo, A. 2004. Propagación de plantas por cultivo in vitro: una biotecnología que nos acompaña hace mucho tiempo.
-ECHENIQUE V, et al. Biotecnología y mejoramiento vegetal. INTA, Argentina 2004.
-El portal de la biología y ciencia de la salud. Revista numero7 Micropropagación de un cultivo perenne. Francisco Fontúrbel fonturbel@mbotanica.zzn.com http://www.biologia.org/?pid=5000&id=47&page=0 [Citado en mayo 10 de 2010]
- INIA, Uruguay. Beltrán, J. y I. Barrios. 2004. Micropropagación in vitro de la caña flecha (Gynerium sagittatum) (Aubl)
-PACHECO. Maldonado, JOSÉ. Constantino. CASTELLANO. Corredor, MARÍA. Cristina. Roble y pino Colombiano. Aspectos biotecnológicos. Ed. UPTC.
-LOPEZ. E. CARLOS. Enraizamiento y aclimatación de plantas obtenidas in vitro http://www.encuentros.uma.es/encuentros31/enraizamiento. [ citado en mayo 14 de 2010]
-Micropropagation - Definitions from Dictionary.com». dictionary.reference.com. Consultado el 17-03-2008.
-Revista de innovación Tecnológica. Micropropagación masiva de plantas. http://cinntec.misiones.gov.ar-micropropagacion [Citado en mayo 15 de 2010]
http://www.sica.gov.ec/agronegocios/productos%20para%20invertir/fibras/microprop.htm